2025-10-02 06:07:30
在药物组合筛选领域,新兴技术不断涌现,为筛选工作带来新的突破,其中机器学习和人工智能算法、微流控技术等应用宽泛且极具潜力。机器学习和人工智能算法凭借强大的数据处理与分析能力,成为药物组合筛选的有力工具。这些算法能够对海量的药物数据、疾病信息以及生物分子数据进行深度挖掘和建模。以深度学习算法为例,它可以对基因表达数据进行分析,通过复杂的神经网络模型,挖掘出与疾病相关的分子特征。科研人员利用这些特征,能够预测哪些药物组合可以调节这些关键分子,从而实现对疾病的有效干预。例如,在针对某种罕见ancer的研究中,通过分析患者的基因表达谱,利用机器学习算法预测出特定的靶向药物与免疫**药物的组合,显著提高了对肿瘤细胞的抑制效果 。这个高通量筛选天然产品库不要错失——陶术化合物库!小分子抑制剂的筛选方法

耐药株的出现是病原体(如细菌、病毒、肿瘤细胞)在长期药物压力下通过基因突变或表观遗传调控获得生存优势的必然结果。以细菌耐药为例,世界卫生组织(WHO)数据显示,每年全球约70万人死于耐药菌影响,若不采取干预措施,这一数字预计在2050年升至1000万。在tumor**领域,靶向药物(如EGFR-TKI)和免疫**(如PD-1抑制剂)的广泛应用加速了耐药株的演化,导致患者中位生存期缩短。耐药株筛选的关键目标是通过体外或体内模型模拟药物选择压力,解析耐药机制,为新型药物研发和联合用药策略提供依据。例如,在结核病**中,通过逐步增加异烟肼浓度筛选耐药株,发现katG基因突变是导致耐药的关键因素,为开发针对突变株的化合物奠定了基础。化合物库高通量筛选方法高通量筛选技能加速联合用药研讨。
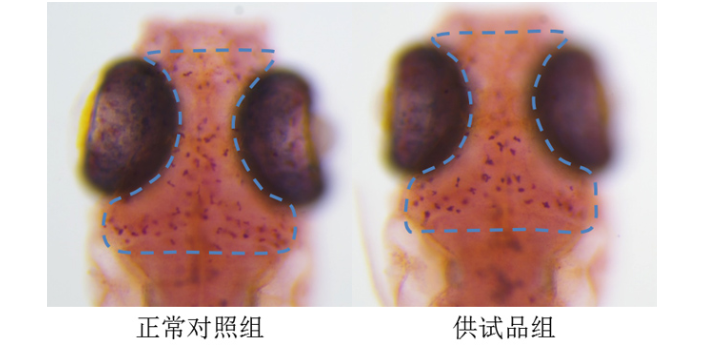
环特生物将类organ技术与药物筛选深度融合,形成覆盖样本库构建、药筛平台建设及技术授权的“2+1”服务体系。其类organ生物样本库涵盖30余种实体tumor模型,包括胃ancer、肺ancer、乳腺ancer等高发ancer种,以及肝、肾、心脏等正常组织类organ,可支持药物**性评价与疾病模型构建。例如,基于人肝类organ的毒性评价体系,环特成功预测了多种化合物对肝脏的潜在损伤,其预测准确率达85%以上,符合欧洲选择性分析方法评价中心(ECVAM)的“优异”标准。在技术授权方面,环特为药企提供类organ培养、高通量筛选及数据分析的全流程解决方案,助力客户缩短新药研发周期30%以上,降低临床前成本40%。
在现代医学与药学领域,药物组合筛选具有至关重要的地位。单一药物**往往存在局限性,难以完全攻克复杂疾病,如ancer、神经退行性疾病等。这些疾病的发生和发展涉及多个生物分子、信号通路和细胞机制,单一药物只能作用于某一靶点,无法实现多方面**。而药物组合通过协同作用,可同时作用于疾病的多个环节,增强疗效、降低耐药性的产生。例如,在ancer**中,传统化疗药物与靶向药物的组合使用,能够在杀伤肿瘤细胞的同时,抑制tumor血管生成,显著提高患者的生存率和生活质量。随着基因组学、蛋白质组学等生命科学技术的快速发展,疾病相关靶点不断被发现,为药物组合筛选提供了更多潜在的作用位点,也使得药物组合筛选成为药物研发的重要方向。然而,药物组合的数量庞大,如何高效筛选出具有协同作用的药物组合,成为科研人员面临的重要挑战。高通量药物筛选的意义及其在我国的发展趋势。
药物组合筛选的技术路径涵盖从高通量筛选到机制验证的全链条。首先,基于疾病模型(如细胞系、类organ或动物模型)构建药物库,包含已上市药物、天然化合物及靶向分子等,通过自动化平台(如机器人液体处理系统)实现药物组合的快速配制与剂量梯度设置。例如,在抗tumor组合筛选中,可采用96孔板或384孔板,将化疗药(如紫杉醇)与靶向药(如EGFR抑制剂)按不同比例混合,通过细胞活力检测(如CCK-8法)或凋亡标记物(如AnnexinV/PI双染)评估协同效应。关键实验设计需考虑“剂量-效应矩阵”,即固定一种药物浓度,梯度变化另一种药物浓度,生成协同指数(如CI值)热图,精细定位比较好协同剂量组合。此外,需设置单药对照组与阴性对照组,排除非特异性相互作用干扰。对于复杂疾病(如神经退行性疾病),还需结合3D细胞模型或斑马鱼模型,模拟体内微环境,提高筛选结果的生理相关性。怎么规划高通量筛选?小分子抑制剂的筛选方法
高通量筛选技能包含机器人技能、液体处理器、数据处理、相当多的软件和敏感的检测体系。小分子抑制剂的筛选方法
药物组合筛选正从“经验驱动”向“数据智能”转型,其未来趋势体现在三个维度:一是多组学数据整合,通过构建药物-靶点-疾病关联网络,挖掘隐藏的协同机制。例如,整合药物化学结构、蛋白质相互作用及临床疗效数据,可发现“老药新用”的组合机会(如抗抑郁药与抑炎药的联用**抑郁症);二是人工智能深度应用,基于生成对抗网络(GAN)或强化学习设计新型药物组合,突破传统组合思维。例如,DeepMind开发的AlphaFold3已能预测药物-靶点复合物结构,为理性设计协同组合提供工具;三是临床实时监测与动态调整,通过可穿戴设备或液体活检技术持续采集患者生物标志物(如循环tumorDNA、代谢物),结合数字孪生技术模拟药物组合效果,实现**方案的实时优化。终,药物组合筛选将与精细**、再生医学及合成生物学深度融合,推动医学从“对症**”向“系统调控”跨越,为复杂疾病**带来改变性突破。小分子抑制剂的筛选方法